| |
| Med Sci (Paris). 2009 June; 25(6-7): 651–654. Published online 2009 June 15. doi: 10.1051/medsci/2009256-7651.Polyploïdie cellulaire dans le tissu hépatique : nouveau rôle de l’insuline Séverine Celton-Morizur and Chantal Desdouets* Institut Cochin, Université Paris Descartes, Inserm U567, CNRS UMR 8104, 24, rue du Faubourg Saint-Jacques, 75014 Paris, France MeSH keywords: Aneuploïdie, Division cellulaire, Hépatocytes, Humains, Nourrisson, Nouveau-né, Insuline, Foie, Phosphatidylinositol 3-kinases, Ploïdies, Polyploïdie, Protéines du proto-oncogène c-akt |
La polyploïdie hépatocytaire Décrite pour la première fois il y a près de 100 ans chez les plantes, la polyploïdie cellulaire, définie par un contenu en ADN supérieur à 2n (n étant le nombre de chromosomes spécifique de l’espèce), est une caractéristique largement répandue dans le monde eucaryote. Les cellules polyploïdes sont produites dans différentes circonstances : étapes programmées du développement, réponse à un stress ou à une infection virale, état pré-tumoral [
1]. Deux mécanismes contrôlent la genèse de ces cellules polyploïdes ou contrôlent la genèse du processus de polyploïdisation : la fusion cellulaire ou une modification du cycle de division conduisant à une endoréplication ou à une cytocinèse incomplète1 [
9]. La polyploïdie hépatocytaire est une caractéristique importante de la croissance et du développement du foie des mammifères [
2] et l’acquisition d’une polyploïdie élevée est généralement considérée comme le témoin d’une différenciation terminale des hépatocytes. Alors qu’à la naissance le foie est exclusivement constitué d’hépatocytes diploïdes (2n), au moment du développement post-natal une polyploïdisation progressive s’installe dans le parenchyme hépatique avec l’apparition d’hépatocytes tétraploïdes (4n) puis octoploïdes (8n) comprenant un ou deux noyaux. Bien que le foie adulte soit un organe quiescent, il conserve néanmoins une capacité proliférative importante sous l’effet de différents stimulus ou agressions (hépatectomie partielle, stress oxydant, surcharges métaboliques…). En réponse à ces signaux, la prolifération est associée à une augmentation de la ploïdie hépatocytaire [2]. Au cours de ces dernières années, nos travaux ont permis de décrypter les mécanismes contrôlant la genèse des hépatocytes polyploïdes. Par une approche de vidéo-microscopie en temps réel, nous avons montré que lors du développement post-natal du foie chez des rongeurs, certains hépatocytes diploïdes adoptent un cycle de division original et effectuent une cytocinèse incomplète [
3]. Dans ces hépatocytes, l’absence de remodelage du cytosquelette d’actine et de myosine au plan de division empêche le recrutement de la GTPase Rho-A, protéine clé dans la formation de l’anneau contractile2 [
4]. Ce mécanisme physiologique particulier génère ainsi un hépatocyte tétraploïde binucléé (2 × 2n), cellule clé dans la mise en place progressive de la polyploïdisation hépatocytaire (Figure 1).
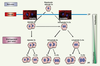 | Figure 1.
Lignage hépatocytaire au cours du développement post-natal. Au moment du sevrage, un hépatocyte diploïde effectue soit une cytocinèse complète (réorganisation du cytosquelette d’actine au plan de division ; flèches pleines) et génère alors deux hépatocytes diploïdes, soit il s’engage dans une cytocinèse incomplète (absence de réorganisation du cytosquelette d’actine ; flèches pointillées) et génère un hépatocyte tétraploïde binucléé 2 × 2n. L’émergence de ces cycles de division particuliers contribue à la polyploïdisation du tissu hépatique. |
|
Quels signaux physiologiques contrôlent la genèse des hépatocytes tétraploïdes ? Nos travaux récents démontrent que lors du développement post-natal du foie, le sevrage influence directement l’initiation des événements de cytocinèse incomplète [
5]. Par une étude immunohistochimique permettant de détecter les événements de cytocinèse in vivo, nous avons montré que chez un rat de 19 jours non sevré, aucun événement de cytocinèse incomplète n’est observé ; au contraire, chez un rat de 19 jours sevré précocement à 15 jours, ce processus a débuté et l’on observe la formation d’hépatocytes tétraploïdes 2 × 2n (Figure 2A). La transition allaitement-sevrage est une période riche en importantes modifications nutritionnelles et hormonales et qui s’accompagne de la mise en place des rythmes circadiens [
6]. Nos résultats démontrent que ni l’apport de carbohydrates, ni la mise en place des rythmes circadiens ne régulent le phénomène de tétraploïdie hépatocytaire. À l’inverse, une modulation du signal insulinique au moment du sevrage induit des variations importantes dans la genèse du contingent tétraploïde 2 × 2n. En effet, une diminution du taux d’insuline circulante (reproduite expérimentalement en administrant aux rats un agent diabétogène) entraîne une diminution drastique du nombre d’hépatocytes tétraploïdes (Figure 2B). A contrario, l’élévation du taux d’insuline circulante (via une injection d’insuline) stimule le développement d’hépatocytes tétraploïdes (Figure 2B).  | Figure 2.
La concentration d’insuline régule la genèse d’hépatocytes tétraploïdes 2 × 2n. A. Immunohistochimie sur coupes de tissu hépatique (marquage Hoechst (ADN)/bleu et β-caténine (membrane)/rouge) permettant de différencier le contingent diploïde 2n et tétraploïde 2 × 2n. B. L’injection de la streptozotocine (STZ/agent diabétogène) réduit de manière drastique la genèse d’hépatocytes tétraploïdes par rapport à des individus contrôles (− 88 %). L’augmentation du taux d’insuline circulante amplifie le nombre de cellules tétraploïdes (+ 33 %). |
|
La voie PI3k-Akt régule la tétraploïdie hépatocytaire La voie PI3-Kinase/Akt représente l’une des voies de signalisation majeure contrôlée par l’insuline. De nombreuses études révèlent notamment son implication dans l’organisation du cytosquelette lors de processus de migration et de polarisation cellulaires [9,
10]. Dans le foie, l’absence de réorganisation du cytosquelette est associée à une altération du programme de cytocinèse [6]. Nous démontrons que dans un système de culture primaire d’hépatocytes, la modulation de l’activité de la voie PI3K/Akt régule les événements de cytocinèse incomplète. Ainsi, le traitement d’hépatocytes par un inhibiteur spécifique de la PI3-kinase se traduit par une diminution significative de ce processus alors que l’inhibition de la voie des MAP-kinases également contrôlée par l’insuline, ne le perturbe pas. Finalement, une modulation directe de l’activité de la protéine Akt est suffisante pour réguler la mise en place de ces cycles de divisions particuliers dans le tissu hépatique. |
En conclusion, l’ensemble de nos résultats représente la première démonstration que chez les mammifères, un signal insulinique contrôle un programme spécifique de division cellulaire et conduit dans le foie à la genèse de cellules tétraploïdes. La résistance à l’insuline est associée à de nombreuses pathologies hépatiques, notamment chez des sujets présentant un diabète de type II ou une obésité ; il serait donc particulièrement intéressant de déterminer si des modifications du profil de ploïdie peuvent accompagner et/ou participer au développement de ces maladies. |
Ce travail a été financé par l’Inserm, le programme ANR Jeunes Chercheurs (ANR-05-JCJC-0168-01), la Ligue Comité de Paris (RS09/75-70), l’ARC (ARC-1033) et la région Ile de France (DIM « Cardio-vasculaire, Diabète, Obésité »).
|
Footnotes |
1. Storchova Z, Kuffer C. The consequences of tetraploidy and aneuploidy. J Cell Sci 2008; 121 : 3859–66. 2. Gupta S. Hepatic polyploidy and liver growth control. Semin Cancer Biol 2000; 10 : 161- 71. 3. Guidotti JE, Bregerie O, Robert A, et al. Liver cell polyploidization: a pivotal role for binuclear hepatocytes. J Biol Chem 2003; 278 : 19095–101. 4. Margall-Ducos G, Celton-Morizur S, Couton D, et al. Liver tetraploidization is controlled by a new process of incomplete cytokinesis. J Cell Sci 2007; 120 : 3633–9. 5. Celton-Morizur S, Merlen G, Couton D, et al. The insulin/Akt pathway controls a specific cell division program that leads to generation of binucleated tetraploid liver cells in rodents. J Clin Invest 2009; 119 (sous presse). 6. Girard J, Ferre P, Pegorier JP, et al. Adaptations of glucose and fatty acid metabolism during perinatal period and suckling-weaning transition. Physiol Rev 1992; 72 : 507–62. 7. Buttrick GJ, Wakefield JG. PI3-K and GSK-3: Akt-ing together with microtubules. Cell Cycle 2008; 7 : 2621–5. 8. Sarbassov DD, Ali SM, Kim DH, et al. Rictor, a novel binding partner of mTOR, defines a rapamycin-insensitive and raptor-independent pathway that regulates the cytoskeleton. Curr Biol 2004; 14 : 1296–302. 9. Échard A. Dissection de la séparation cellulaire au scalpel protéomique. Med Sci (Paris) 2004; 20 : 845–6. 10. Monzo P, Cormont M. CD2AP, un adaptateur moléculaire entre l’endocytose et le cytosquelette d’actine dans la cellule en interphase et pendant la cytocinèse ? Med Sci (Paris) 2005; 21 : 1036–7. |



